摘要:目的 基于GEO高通量测序结果,结合网络药理学和分子对接等方法,预测升麻鳖甲汤治疗系统性红斑狼疮(systemic lupus erythematosus, SLE)的潜在微观机制。方法 使用TCMSP、Batman-TCM、PubChem和SwissTargetPrediction数据库筛选升麻鳖甲汤的活性成分和靶点。应用GEO芯片数据挖掘分析筛选 SLE患者中差异表达基因,进行升麻鳖甲汤与SLE的交集基因集富集分析、蛋白互作关系与组织定位分析并构建药靶、通路与定位相关的复杂网络。此外,筛选药物参与治疗的核心成分和核心靶标并完成分子对接验证。结果 升麻鳖甲汤治疗SLE的有效成分为102种,潜在靶点66个,富集通路主要涉及IL-17相关通路、脂质和动脉粥样硬化,定位多在肝、全血中。分子对接结果表明各核心成分与靶点间结合活性均较好。结论 升麻鳖甲汤对SLE的疗效机制可能与调节免疫炎症与脂质代谢有关。
关键词:网络药理学;GEO芯片;分子对接;升麻鳖甲汤;系统性红斑狼疮;作用机制
中图分类号:R284
Mechanisms of Shengma Biejia Decoction in treatment of systemic lupus erythematosus based on GEO chip analysis and network pharmacology
SHAN Xueyan1,2 GUO Zilin1 TANG Xiaopo1(Corresponding author)
1. Guang'anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053
2. Beijing University of Chinese Medicine, Beijing 100029
Abstract: Aim Based on the analysis of network pharmacology, GEO chip and molecular docking technology, to predict the potential mechanism of Shengma Biejia Decoction(SMBJD) in the treatment of systemic lupus erythematosus (SLE). Methods Active components and targets of SMBJD were screen out by TCMSP, Batman-TCM, PubChem and SwissTargetPrediction database . Differential expression of SLE was obtained with GEO chip. The enrichment analysis, protein interaction and gene localization analysis of the intersection genes of SMBJD and SLE were used to screen out the core components and targets and construct "compound-component-target-pathway-localization-disease" network. Molecular docking was confirmed the binding activity of core components and targets. Results 102 components and 66 potential targets of SMBJD were screened out. The enrichment pathway mainly involves IL-17 signaling pathway, lipid and atherosclerosis. Gene mapping was mainly over the liver and whole blood and molecular docking confirmed good binding activities. Conclusions SMBJD may play a therapeutic role in SLE by regulating immune inflammation and lipid metabolism.
Keywords: network pharmacology; GEO chip; molecular docking; ShengmaBiejia Decoction (升麻鳖甲汤); systemic lupus erythematosus; mechanism
系统性红斑狼疮(systemic lupus erythematosus, SLE)是以全身多系统受累与血清中出现自身抗体为典型特点的慢性弥漫性结缔组织病。该病好发于育龄期女性,其临床表现多样,病变可累及皮肤黏膜、关节滑膜、肌肉,也可引起泌尿、循环、神经系统受累[1]。糖皮质激素、免疫抑制剂和生物制剂等是SLE的主要治疗手段,但这些药物往往会引起代谢紊乱、骨质疏松、消化道溃疡或穿孔等毒副反应[2]。
SLE按照其临床特点可归入“阴阳毒”的中医范畴,核心病机以阴虚血热为主。素体偏颇,阴阳失调、气滞血瘀进而产生一系列病理产物即内因,外感毒邪即外因,二者合而发病,正邪相搏于肌表则多见热象为阳毒,相搏于筋肉血脉多见瘀象则为阴毒。升麻鳖甲汤是《金匮要略》中治疗阴阳毒病的典型代表方剂,由升麻、鳖甲、当归、甘草、蜀椒、雄黄组成。临床研究中证实其增效减毒的功效[3],在SLE治疗中可明显减轻糖皮质激素毒副作用并增强治疗效果,但其确切机制不明。因此,本研究运用GEO芯片分析方法结合网络药理学与分子对接技术,探索升麻鳖甲汤对SLE的治疗机理,解析该方的关键有效成分与作用靶点,以期为SLE的防治提供新的思路。
1 资料与方法
1.1 升麻鳖甲汤活性成分、靶点筛选与网络构建
通过TCMSP数据库以口服利用度(OB)≥30%且类药性(DL)≥0.18作为筛选标准检索出升麻、当归、甘草、蜀椒的化学成分并进行预测得到相应的靶点蛋白。在BATMAN-TCM数据库中以预测分数≥20且Benjamini-Hochberg多元检测校正后P值<0.05为筛选标准检索鳖甲、雄黄的化学成分,并通过检索文献对中药化学成分进行补充。在此基础上通过PubChem数据库,对获得的有效成分进行SMILES晶体结构查询。在删除不能查询到晶体结构者后,在Swiss Target Prediction数据库中进行目标靶点预测,利用Uniprot数据库进行Gene Symbol转化并建立活性成分靶点数据集。
应用Cytoscape 3.9.1软件构建升麻鳖甲汤的方药-成分-靶点关系网络图,导入数据集中信息并获得升麻鳖甲汤治疗SLE可能涉及的化合物和相关靶点。
1.2 GEO基因芯片及其差异分析
通过GEO数据库选取SLE相关基因集GSE50772[4],该基因集包含61例SLE患者与20例正常志愿者的外周血单核细胞转录组数据。采用R4.2.2软件limma包以校正后P<0.05且|log FC|≥0.5为标准进行SLE差异基因分析,以ggplot2包绘制火山图,pheatmap包绘制聚类热图。
1.3 获取升麻鳖甲汤治疗SLE的潜在靶点与核心成分
利用Venny 2.1将得到的药物靶点基因与疾病差异基因绘制韦恩图,交集基因即升麻鳖甲汤治疗SLE有关的潜在靶点。将其与对应成分导入Cytoscape 3.9.1软件,选取Degree值前5名药物成分作为升麻鳖甲汤治疗SLE的核心成分。
1.4 蛋白互作(PPI)网络图构建及核心靶点筛选
将交集基因集导入STRING数据库,依次选择物种“Homosapiens”,最高置信度>0.4,隐藏独立节点,建立蛋白质互作网络(Protein-Protein Interaction Networks,PPI),并与Cytoscape 3.9.1软件中进行可视化分析。使用Cytohubba插件选择MCC、MNC、Degree、Closeness四种算法分别筛选度值前10名的靶点,利用在线工具jvenn取其交集,交集靶点即升麻鳖甲汤治疗SLE的核心靶点。利用R4.2.2软件中RColorBrewer包、ggpubr包绘制 GEO 数据集中核心靶点的小提琴图。
1.5 基因本体分析(GO)与京都基因和基因组百科全书(KEGG)分析
在R4.2.2中基于clusterProfiler程序包对潜在靶点进行GO功能分析与KEGG通路富集分析。从生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)角度进行GO分析并绘制柱形图与圈图。按P<0.05为条件,选取前20条KEGG通路并利用R4.2.2软件绘制柱形图与气泡图。
1.6 分子对接
在PubChem数据库下载核心成分3D结构PDB格式文件。通过Uniprot数据库查找核心靶点基因对应蛋白并在PDB数据库(https://www.rcsb.org/)下载其受体。用AutoDock Vina软件对晶体机构预处理,包括去水、加氢、修饰氨基酸、优化能量和调整力场参数。利用PyRx软件(https://pyrx.sourceforge.io/)将靶点结构与活性成分结构进行分子对接。选择结合能最低的4种化合物在Discovery Studio 2020 Client(https://discover.3ds.com/discovery-studio-visualizer-download)中进行可视化。
1.7 基因表达量定位分析
利用BioGPS数据库(http://biogps.org)检索潜在靶点在心、肝、胰、肺、肾、全脑、全血的表达情况,并筛选出每个基因表达量最高的器官进行统计。在Cytoscape 3.9.1软件中利用上述得到的活性成分、潜在治疗靶点、组织定位数据与KEGG富集通路,绘制药物-成分-靶点-通路-定位-疾病网络图。
2 结果
2.1 升麻鳖甲汤成分靶点筛选与网络构建
TCMSP数据库得到当归有效成分2种,升麻6种,甘草88种,蜀椒5种。Batman-TCM数据库得到雄黄成分2种,鳖甲1种。通过检索文献补充雄黄的活性成分有四硫化四砷(Tetraarsenic tetrasulfide)、三氧化二砷(Arsenic trioxide)[5],补充鳖甲的活性成分有半乳糖(Galactose)、甘氨酸(Glycine)、脯氨酸(Proline)[6-7]。排除在SwissTargetPrediction数据库未获取预测靶点的成分,最后得到当归2种、升麻6种、甘草88种、蜀椒5种、雄黄1种、鳖甲2种,有效活性成分共102种,预测得到共2199个药物靶点。利用Cytoscape 3.9.1软件构建升麻鳖甲汤的方药-成分-靶点关系网络图,见图 1。
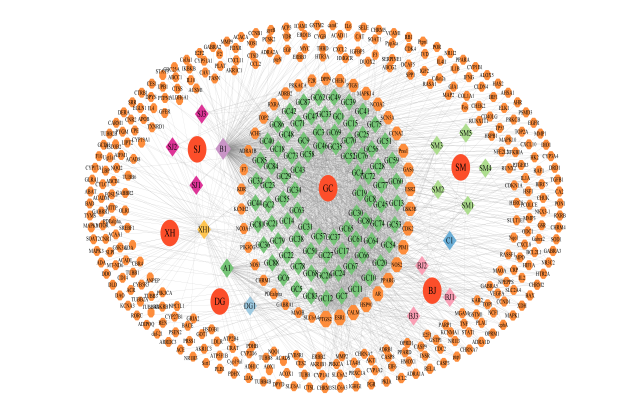
图1 复方-中药-成分-靶点网络图
2.2 GEO芯片差异分析结果
筛选出基因集GSE50772中SLE患者与正常志愿者的差异表达基因共3550个,其中上调基因1448个,下调基因2102个。将得到的3350个差异表达基因进行火山图(图 2A)与聚类热图(图 2B)绘制,以确定两组表达水平确有显著差异。
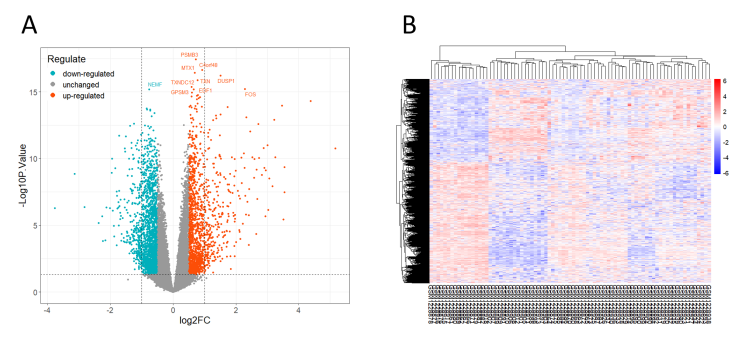
图2 GSE50772数据集差异基因分析
2.3 升麻鳖甲汤治疗 SLE 的潜在靶点与核心成分
将升麻鳖甲汤(SMBJD)成分靶点和SLE差异表达基因绘制Venn图,得到66个交集靶点(图3),即升麻鳖甲汤治疗SLE的潜在靶点。将潜在靶点与药物成分导入Cytoscape 3.9.1软件后,Degree值前5名的药物成分分别为槲皮素、山奈酚、异鼠李素、刺芒柄花素、β-谷甾素(表1),即升麻鳖甲汤治疗SLE的核心成分。
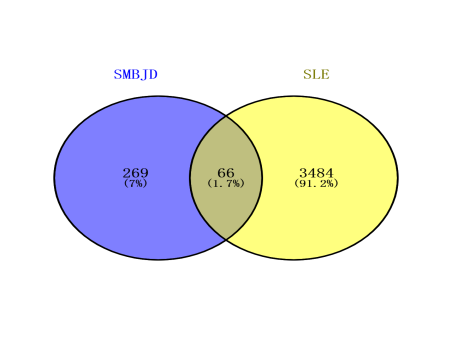
图3 交集靶点Venn图
表1 升麻鳖甲汤治疗SLE的核心成分
中文名称
英文名称
Degree 值
MOL000098
槲皮素
Quercetin
72.0
MOL000422
山奈酚
Kaempferol
14.0
MOL000354
异鼠李素
Isorhamnetin
9.0
MOL000392
刺芒柄花素
Formononetin
9.0
MOL000358
β-谷甾素
Beta-Sitosterol
8.0
2.4 PPI网络构建与核心靶点筛选
将66个潜在靶点导入STRING数据库获得的PPI网络(图 4A),该网络有66个节点、455条边。将其导入Cytoscape软件进行初步整理以备核心靶点筛选(图 4B),节点代表中药治疗SLE的潜在靶点,靶点间的相互度值越大则其节点越大、颜色越深、对应的边越粗,表明该节点越重要。取Cytohubba插件4种算法的交集基因(图 5),最终获得核心靶点CXCL8、IL1B、PPARG、TNF、MAPK3、MMP9、IL10、PTGS2,说明升麻鳖甲汤可能主要通过这些蛋白发挥SLE的治疗作用。如图 6 所示,SLE组的8 种核心基因在SLE患者中均呈上调表达。
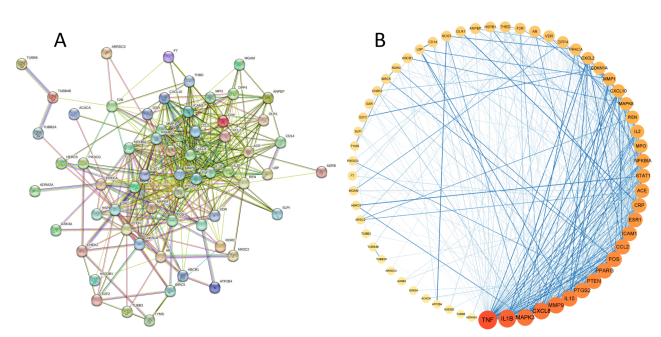
图4 交集靶点PPI网络
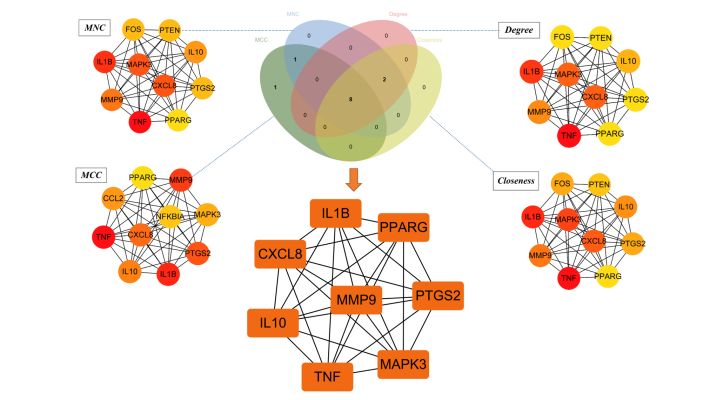
图5 核心靶点筛选
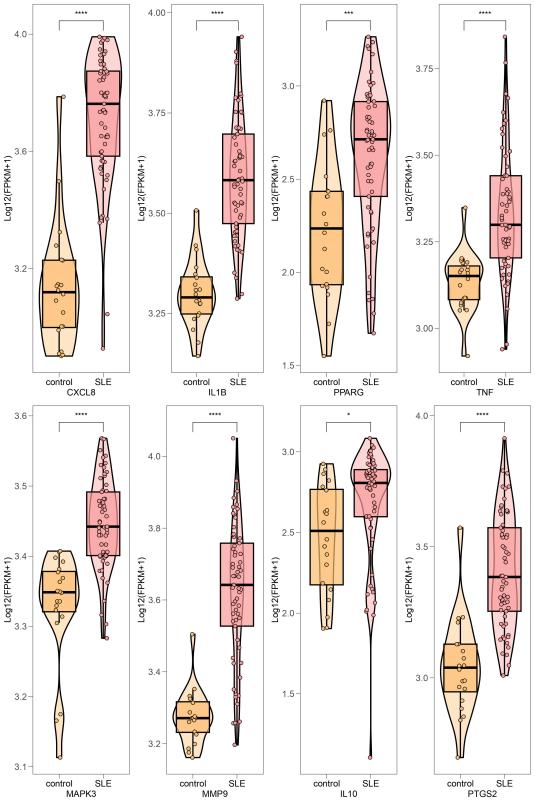
图6 SLE患者与正常人群核心基因的表达差异
2.5 GO与 KEGG 富集分析
由GO功能分析绘制气泡图(图 4A)与圈图(图 4B)可知,BP主要富集到脂多糖反应(response to lipopolysaccharide)、细菌源分子反应(response to molecule of bacterial origin)、外部刺激反应的正调节(positive regulation of response to external stimulus)等。CC富集于细胞膜筏(membrane rafts)、膜微区(membrane microdomain)、质膜外侧面(external side of plasma membrane)等。MF富集于G蛋白耦联受体结合(G protein−coupled receptor binding)、细胞因子受体结合(Cytokine Receptor Binding)、细胞因子活性(cytokine activity)等。
KEGG分析结果在条形图(图 5A)与气泡图(图 5B)中展示。富集程度较高的信号通路主要涉及白细胞介素-17信号通路(IL−17 signaling pathway)、脂质代谢和动脉粥样硬化(lipid and atherosclerosis) 、肿瘤坏死因子信号通路(TNF signaling pathway)。其中IL-17信号通路富集程度最显著,有13个靶点富集在该通路上(图9)。
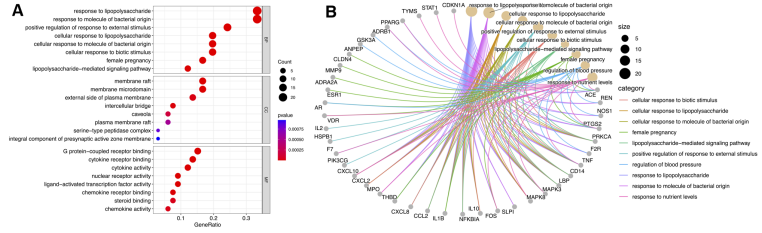
图7 GO功能分析结果
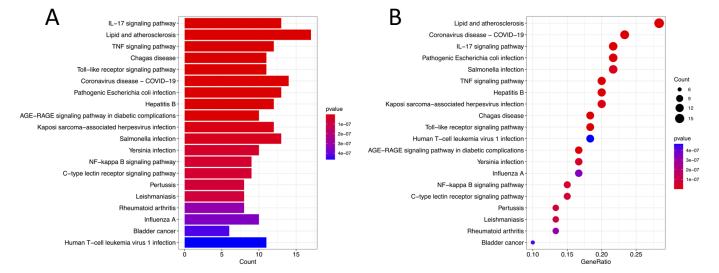
图8 KEGG分析结果
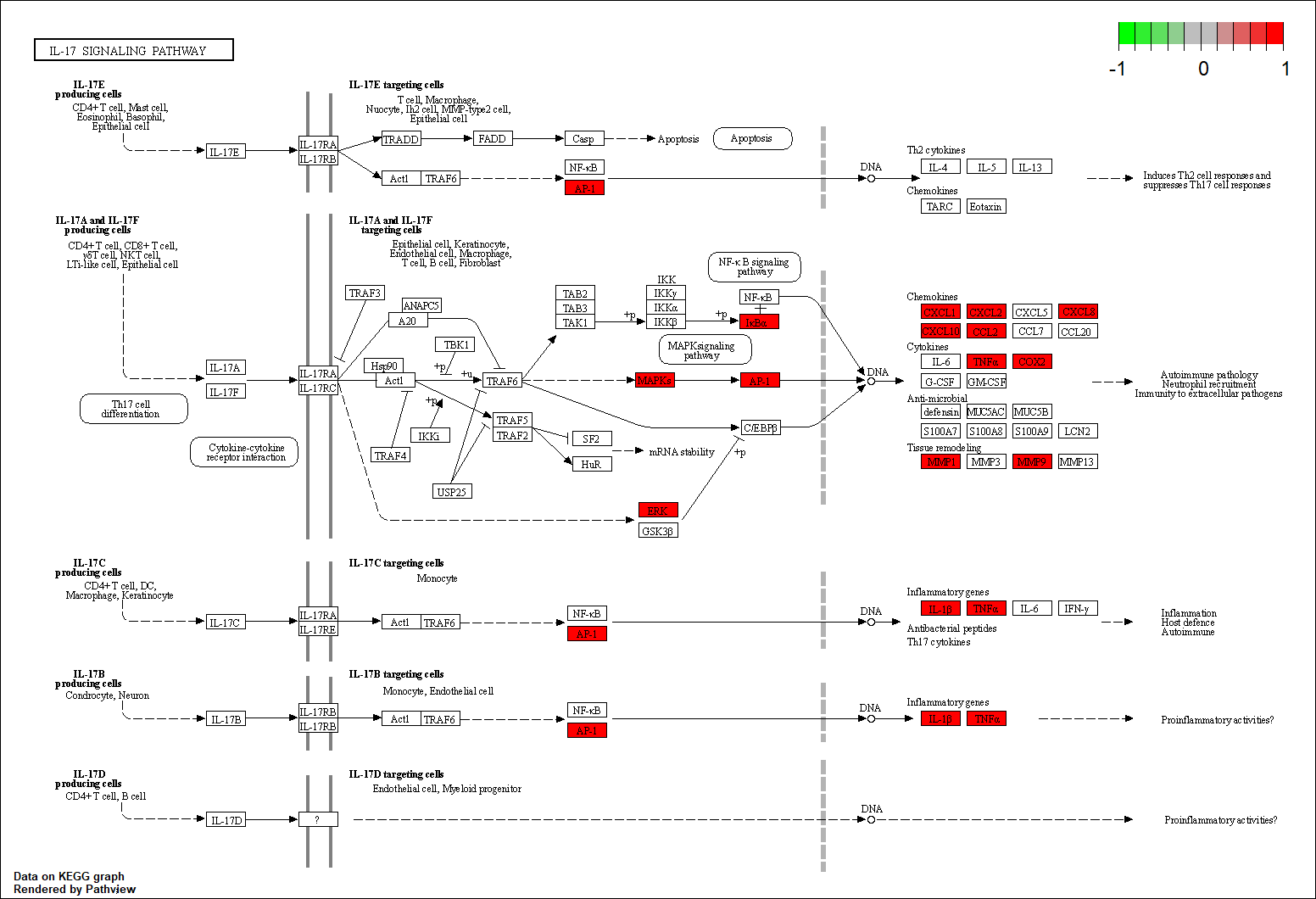
图9 IL-17信号通路图
2.6 分子对接结果
分子对接验证结果显示5种核心成分与8种核心靶点之间的结合自由能均小于-5 kcal·mol-1,表明其具有较好的结合能力(表2)。MMP9与槲皮素呈现出最低的结合能,为-10.6 kcal·mol-1;其次是MMP9与刺芒柄花素(-10.4 kcal·mol-1);MMP9与山柰酚(-10.1 kcal·mol-1);PPARG与槲皮素(-9.9 kcal·mol-1)。成分与靶点间的结合能数值越小,其配合物的构象则越稳定,结合活性越强。将4种结合化合物进行可视化分析(图10)。
表2 核心成分与核心靶点对接结合能(kcal·mol-1)
β-谷甾醇
(Beta-Sitosterol)
槲皮素
(Quercetin)
刺芒柄花素
(Formononetin)
山柰酚
(Kaempferol)
异鼠李素
(Isorhamnetin)
CXCL8
-6.7
-6.2
-6.2
-6.3
-6.3
IL10
-8.2
-6.5
-6.7
-6.7
-6.5
IL1B
-7.2
-7.2
-6.5
-6.8
-6.9
MAPK3
-7.3
-8.7
-7.8
-8.1
-7.5
MMP9
-9.7
-10.6
-10.4
-10.1
-9.8
PPARG
-8.6
-9.9
-7.7
-8.7
-8.5
PTGS2
-7.7
-9.1
-8.8
-8.9
-8.9
TNF
-9.1
-9.1
-8
-8.8
-8.9
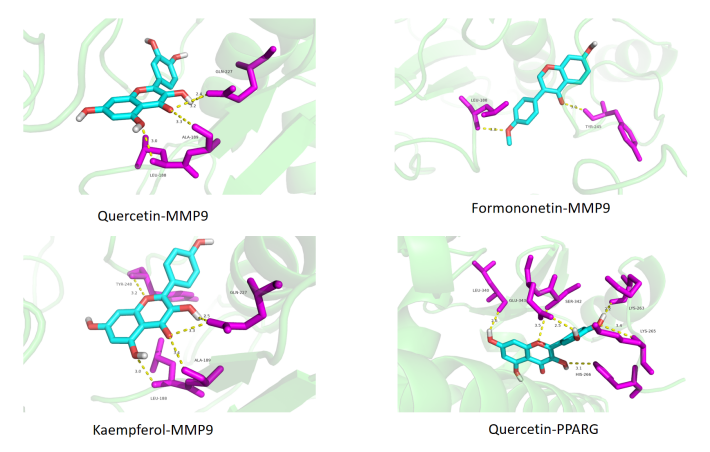
图10 分子对接可视化图
2.7 靶点表达量定位分析与“成分-靶点-通路-定位-疾病”网络建立
升麻鳖甲汤对SLE的治疗机制可能涉及到多个器官。利用BioGPS数据库检索66个潜在靶点在人体器官组织的表达情况。潜在靶点广泛分布于肝、心、肺、肾、全血、全脑等组织,分布最多的是肝,心、全血、肺并列其后(图 11)。而核心靶点在全血中分布最多,其次是肝与全脑。将上述结果共同建立复方-成分-靶点-通路-定位-疾病网络图(图 11)。
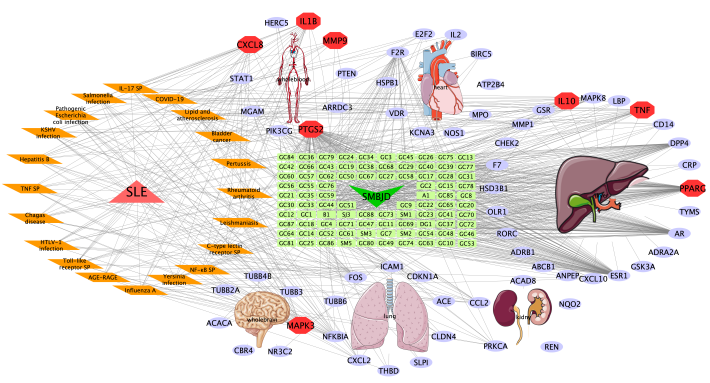
图11 复方-成分-靶点-通路-定位-疾病网络图
3 讨论
SLE在中医古籍记载中尚无明确病名,但多数医家认为其临床表现与阴阳毒病相类似。现多认为SLE以阴虚血热为核心病机,瘀阻贯穿疾病始终[3]。《金匮要略》中治疗阴阳毒的代表方升麻鳖甲汤具有清热解毒、凉血消斑的功效,王孟英《温热经纬》中称其有“解阳分之毒,救阴分之血”的妙效,在SLE临床治疗中屡屡效验,但其具体作用机制尚未阐明。
SLE的病理关键在血中“毒、热、瘀”。肝为血府,既可藏血又可调节血液运行,而血液的推动运行全赖于心肺之气,定位分析显示亦升麻鳖甲汤既可直接作用于全血,也可通过调节与血液密切相关的脏腑来发挥治疗作用。SLE的毒热之性不容小觑,邪热燔灼趋上易扰心神,产生一系列中枢神经系统表现,升麻鳖甲汤在控制血热的同时,其核心靶点亦作用于脑。这提示升麻鳖甲汤对SLE的作用机制与多器官、多系统协调作用有密切联系。整体观念是中医理论的基本特点,器官之间是密不可分、相互联系的,其彼此之间相互协调制约,共同执行人体的生理功能。本研究采用基于GEO芯片数据的网络药理学探讨SLE与具有多成分、多靶点的升麻鳖甲汤之间的关系,对升麻鳖甲汤治疗SLE的潜在靶点进行组织定位分析,最后筛选出升麻鳖甲汤的核心成分与治疗靶点并进行分子对接分析,可知其基因主要映射在肝、心、全血、肺中,其核心靶点定位在全血、肝、脑中。着眼于从整体角度分析升麻鳖甲汤调治SLE的分子机制,有利于为后续研究的开展提供理论基础。
初步筛选出升麻鳖甲汤调治SLE的主要活性成分包括槲皮素、异鼠李素、山奈酚、刺芒柄花素与β-谷甾素等。研究表明,槲皮素增加SLE 模型小鼠的脾脏树突状细胞数量,调节Th细胞比例,并通过下调血中TGF-β1、MCP-1表达降低血尿素氮、血肌酐水平、肾脏肥大指数与组织病理评分,对狼疮性肾炎具有保护作用[8-11]。β-谷甾醇通过调节Th17/Treg细胞比例改善促炎和抑炎细胞因子水平[12]。β-谷甾醇、异鼠李素和刺芒柄花素均可抑制NF-κB通路发挥镇痛与免疫调节作用[12-13]。刺芒柄花素还通过调整促凋亡蛋白(Bax)与抗凋亡蛋白(Bcl-2)表达比例来发挥多重免疫调节作用[14]。山奈酚可降低脾脏、胸腺指数与FOXP3磷酸化水平,增强Treg细胞功能从而发挥天然免疫抑制作用。
本研究筛选出升麻鳖甲汤治疗SLE的8个核心靶点,即CXCL8、IL1B、PPARG、TNF、MAPK3、MMP9、IL10、PTGS2。CXCL8在血清与脑脊液的水平分别是SLE活动度和中枢神经系统受累的潜在标志物[15]。IL1β、IL10、TNF的基因多态性与SLE发病风险和疾病表型相关[16]。TNF为促炎细胞因子家族,TNF-α可介导器官损伤和组织炎症导致免疫功能紊乱。IL10在SLE中具有双向作用,其阻碍自身反应性淋巴细胞的活化增殖可抑制炎症反应,但基因多态性与疾病易感性密切相关[17]。IL1β与PTGS2具有激活免疫细胞产生自身抗体的多效促炎作用[18-19]。PPAR-γ(PPARG)表达上调时可作为保护性反馈调节剂,介导TLR2/Sirt1/PPAR-γ信号通路调节巨噬细胞分化[20]。MAPK3又名ERK1,SLE发病可能与ERK信号通路受抑制使ERK1、ERK2磷酸化减少有关[21]。MMP9不仅与SLE患病风险与疾病活动有关,还有助于肾小球毛细血管袢的增殖重塑,可作为狼疮性肾炎患者新月体形成的临床指征[22-23]。上述证据表明核心靶点可能与SLE发生发展和异常免疫状态有重要联系。分子对接结果显示8个核心靶点与5种核心成分均呈现较好的结合能,提示二者之间有一定的生物活性,升麻鳖甲汤对SLE具有多成分多靶点的协同治疗作用。
免疫失常与炎症反应可能是阳分热毒的微观体现,而动脉粥样硬化、免疫复合物沉积类似于阴分毒瘀等病理因素[24-25]。结合富集分析结果,升麻鳖甲汤起效机制与“解阳分之毒,救阴分之血”两方面相关:
(1)调控免疫、减轻炎症、抑制感染以解阳分之毒:IL-17信号通路失调从多重途径诱发SLE发病,IL-17诱导上皮细胞与成纤维细胞产生炎性趋化因子引起炎症反应[26],刺激B细胞扩大免疫反应[27],促进T细胞活化和组织浸润引起靶器官损伤与慢性炎症[27],并可增加血管生成促进炎症[28]。如图 9 ,升麻鳖甲汤的作用靶点主要富集于对SLE具有关键致病作用的IL-17A通路并介导其大部分下游靶点。目前已有IL-17A通路阻断剂(如司库奇尤单抗)进入临床试验阶段并取得一定疗效[29-30],这提示升麻鳖甲汤可能具有类IL-17A抑制剂样治疗作用。TNF信号通路异常引起大量下游促炎信号级联过程产生长期炎症反应[31]。B细胞在胞核内Toll样受体(TLRs)信号通路刺激下分泌大量细胞因子并对自身抗原耐受性丧失[32]。升麻鳖甲汤调控上述途径抑制免疫细胞失控、炎症与组织浸润来清热解毒,且可能通过抑制不同感染途径减少激素与免疫抑制剂造成的副作用。
(2)调节脂质代谢、延缓动脉粥样硬化、减少免疫复合物沉积以救阴分之血:临床中动脉粥样硬化的高血脂环境可激活致病性自身免疫性T细胞反应,促进自身免疫反应从而加重SLE病情[33]。介导胆固醇转运的肝脏X受体可通过上调MERTK表达促进细胞自噬而控制SLE,并可通过NF-κb通路抑制促炎因子产生[34-35]。此外,动脉粥样硬化因素也可影响Th17细胞或B细胞加剧SLE炎症与免疫紊乱[36]。TNF超家族成员B细胞活化因子(BAFF)水平升高是SLE炎症水平升高与免疫复合物沉积的重要因素[37]。升麻鳖甲汤可能通过干预上述通路发挥凉血散瘀的功效。
4 结语
本研究基于生物信息学与网络药理学技术,旨在挖掘经典方剂升麻鳖甲汤对SLE的治疗作用机制,预测其潜在活性化合物、关键靶点与作用通路。研究发现升麻鳖甲汤可能作用于多条SLE的发病通路,尤其是IL-17A信号通路、脂质和动脉粥样硬化通路,其抗炎、维持免疫稳态、调节脂质代谢的潜在治疗机制与“解阳分之毒,救阴分之血”的中医理论功效相符。此外,为升麻鳖甲汤通过多器官、多系统对SLE发挥治疗作用提供理论证据。但由于网络药理学及生物信息学技术自身的局限性,预测结果有待于进一步的实验验证其有效性。
参考文献
[1]姜楠,白炜,赵久良,等.系统性红斑狼疮的诊治方向与研究前沿[J].中国科学:生命科学,2021, 51(8): 887-900.
[2]杨辉,谢志军,李海昌,等.中医药在系统性红斑狼疮激素撤减过程中的问题分析与对策[J].中华中医药杂志,2018, 33(2): 588-591.
[3]韩曼,姜泉.中医治疗系统性红斑狼疮的思路与实践[J]. 中华中医药杂志,2017,32(10):4537-4539.
[4]Kennedy WP, Maciuca R, Wolslegel K, et al. Association of the interferon signature metric with serological disease manifestations but not global activity scores in multiple cohorts of patients with SLE[J]. Lupus Sci Med,2015,2(1):e000080.
[5]刘嵘,濮德敏.雄黄的研究进展[J].时珍国医国药,2007,18(4):982-984.
[6]李彬,郭力城.鳖甲的化学成分和药理作用研究概况[J].中医药信息,2009, 26(1): 25-27.
[7]唐尹萍,刘焱文.鳖甲研究概况[J].中国药师,2010,13(3):423-425.
[8]户庆峰,王学珍,魏新平. 槲皮素对系统性红斑狼疮小鼠肾保护作用及其对转化生长因子-β_1单核细胞趋化蛋白-1的影响分析[J].中华风湿病学杂志, 2019, (5): 309-313, 309, 313, 2.
[9]Liu T, Yang Q, Zhang X, et al. Quercetin alleviates kidney fibrosis by reducing renal tubular epithelial cell senescence through the SIRT1/PINK1/mitophagy axis[J]. Life Sci,2020,257:118116.
[10]Lu H, Wu L, Liu L, et al. Quercetin ameliorates kidney injury and fibrosis by modulating M1/M2 macrophage polarization[J]. Biochem Pharmacol,2018,154:203-212.
[11]王蕊,刘茜,李丽. 槲皮素对系统性红斑狼疮模型小鼠肾脏的保护作用及对其免疫功能的影响研究[J]. 临床和实验医学杂志, 2021, 20(21): 2252-2256.
[12]Gangwar V, Garg A, Lomore K, et al. Immunomodulatory Effects of a Concoction of Natural Bioactive Compounds—Mechanistic Insights[J]. Biomedicines,2021,9(11):1522.
[13]杨宇,胥学冰,蒋殿宇,等. 异鼠李素通过调控NF-κB通路发挥镇痛作用[J]. 第三军医大学学报, 2021, 43(14): 1366-1371.
[14]Liu G, Zhao W, Bai J, et al. Formononetin protects against concanavalin-A-induced autoimmune hepatitis in mice through its anti-apoptotic and anti-inflammatory properties[J]. Biochem Cell Biol,99(2):231-240.
[15]Ghafouri-Fard S, Shahir M, Taheri M, et al. A review on the role of chemokines in the pathogenesis of systemic lupus erythematosus[J]. Cytokine,2021,146:155640.
[16]Rzeszotarska E, Sowinska A, Stypinska B, et al. IL-1β, IL-10 and TNF-α polymorphisms may affect systemic lupus erythematosus risk and phenotype[J]. Clin Exp Rheumatol,2022,(9):1708-1717.
[17]Gibson AW, Edberg JC, Wu J, et al. Novel single nucleotide polymorphisms in the distal IL-10 promoter affect IL-10 production and enhance the risk of systemic lupus erythematosus[J]. J Immunol, 2001,166(6):3915-3922.
[18]Umare V, Pradhan V, Rajadhyaksha A, et al. Predisposition of IL-1β (-511 C/T) polymorphism to renal and hematologic disorders in Indian SLE patients[J]. Gene,2018,641:41-45.
[19]Zhang L, Bertucci AM, Smith KA, et al. Hyperexpression of cyclooxygenase 2 in the lupus immune system and effect of cyclooxygenase 2 inhibitor diet therapy in a murine model of systemic lupus erythematosus.[J]. Arthritis Rheum.2007,56(12):4132-4141.
[20]Liu Y, Luo S, Zhan Y, et al. Increased Expression of PPAR-γ Modulates Monocytes Into a M2-Like Phenotype in SLE Patients: An Implicative Protective Mechanism and Potential Therapeutic Strategy of Systemic Lupus Erythematosus[J]. Front Immunol.2021,11:579372.
[21]Kammer GM, Perl A, Richardson BC, et al. Abnormal T cell signal transduction in systemic lupus erythematosus[J]. Arthritis Rheum,2002,46(5):1139-1154.
[22]Phillips TM, Fadia M, Lea-Henry TN, et al. MMP2 and MMP9 associate with crescentic glomerulonephritis[J]. Clin Kidney J,2017,10(2):215-220.
[23]Vira H, Pradhan V, Umare V, et al. Role of polymorphisms in MMP-9 and TIMP-1 as biomarkers for susceptibility to systemic lupus erythematosus patients[J]. Biomark Med,2019,13(1):33-43.
[24]陈凯,李正富,范永升. 范永升诊治系统性红斑狼疮心脏受累学术经验探析[J]. 中华中医药杂志, 2022, 37(4): 2082-2085.
[25]张翌蕾,崔应麟. 毒邪学说研究进展[J]. 中华中医药杂志, 2020, 35(10): 5074-5076.
[26]Weaver CT, Hatton RD, Mangan PR, et al. IL-17 family cytokines and the expanding diversity of effector T cell lineages[J]. Annu Rev Immunol,2007,25:821-52.
[27]Li D, Guo B, Wu H, et al. Interleukin-17 in systemic lupus erythematosus: A comprehensive review[J]. Autoimmunity,2015,48(6):353-61.
[28]Robak E, Kulczycka-Siennicka L, Gerlicz Z, et al. Correlations between concentrations of interleukin (IL)-17A, IL-17B and IL-17F, and endothelial cells and proangiogenic cytokines in systemic lupus erythematosus patients[J]. Eur Cytokine Netw,2013,24(1):60-8.
[29]Rafael-Vidal C, Pérez N, Altabás I, et al. Blocking IL-17: A Promising Strategy in the Treatment of Systemic Rheumatic Diseases[J]. Int J Mol Sci,2020,21(19):7100.
[30]Satoh Y, Nakano K, Yoshinari H, et al. A case of refractory lupus nephritis complicated by psoriasis vulgaris that was controlled with secukinumab[J]. Lupus,2018,27(7):1202-1206.
[31]Tanzer MC, Bludau I, Stafford CA, et al. Phosphoproteome profiling uncovers a key role for CDKs in TNF signaling[J]. Nat Commun,2021,12(1):6053.
[32]Fillatreau S, Manfroi B, Dörner T. Toll-like receptor signalling in B cells during systemic lupus erythematosus[J]. Nat Rev Rheumatol,2021,17(2):98-108.
[33]McMahon M, Seto R, Skaggs BJ. Cardiovascular disease in systemic lupus erythematosus[J]. Rheumatol Immunol Res,2021,2(3):157-172.
[34]A-Gonzalez N, Bensinger SJ, Hong C, et al. Apoptotic Cells Promote Their Own Clearance and Immune Tolerance through Activation of the Nuclear Receptor LXR[J]. Immunity,2009,31(2):245-58.
[35]Jeon JY, Nam JY, Kim HA, et al. Liver X receptors alpha gene (NR1H3) promoter polymorphisms are associated with systemic lupus erythematosus in Koreans[J]. Arthritis Res Ther,2014,16(3):R112.
[36]Ryu H, Kim J, Kim D, et al. Cellular and Molecular Links between Autoimmunity and Lipid Metabolism[J]. Mol Cells,2019,42(11):747-754.
[37]Jackson SW, Davidson A. BAFF inhibition in SLE—Is tolerance restored?[J]. Immunol Rev,2019,292(1):102-119.
基金项目:中央高水平中医医院临床研究和成果转化能力提升项目——临床科研一体化人才专项(创新团队培育项目)(HLCMHPP2023002)。